Or you want a quick look: Giải bài tập Hóa 9 Bài 5 trang 21
Hoá học 9 Bài 5: Luyện tập Tính chất hóa học của oxit và axit giúp các em học sinh lớp 9 giải nhanh được các bài tập Hóa học 9 chương 1 trang 21.
Việc giải Hóa 9 bài 5 trước khi đến lớp các em nhanh chóng nắm vững kiến thức hôm sau ở trên lớp sẽ học gì, hiểu sơ qua về nội dung học. Đồng thời giúp thầy cô tham khảo, nhanh chóng soạn giáo án cho học sinh của mình. Vậy sau đây là nội dung chi tiết tài liệu, mời các bạn cùng tham khảo tại đây.
Giải bài tập Hóa 9 Bài 5 trang 21
Câu 1
Có những oxit sau: SO2, CuO, CaO, Na2O, CO2. Hãy cho biết những oxit nào tác dụng được với.
a) Nước
b) Axit clohiđric
c) Natri hiđroxit
Viết các phương trình hóa học.
Gợi ý đáp án:
a) Oxit tác dụng với nước là:
SO2 + H2O → H2SO3
Na2O + H2O → 2NaOH
CO2 + H2O → H2CO3
b) Oxit tác dụng với HCl là:
CuO + 2HCl → CuCl2 + H2O
Na2O + 2HCl → 2NaCl + H2O
CaO + 2HCl → CaCl2 + H2O
c) Những oxit tác dụng với natri hiđroxit là:
SO2 + 2NaOH → Na2SO3 + H2O
CO2 + 2NaOH → Na2CO3 + H2O
Câu 2
Những oxit nào dưới đây có thể điều chế bằng:
a) Phản ứng hóa hợp? Viết phương trình hóa học.
b) Phản ứng hóa hợp và phản ứng phân hủy? Viết phương trình hóa học.
1) H2O.
2) CuO.
3) Na2O.
4) CO2.
5) P2O5.
c) Các oxit có thể điều chế bằng phản ứng hóa hợp và phản ứng phân hủy: CuO, CO2, Na2O, H2O
Gợi ý đáp án:
a) Cả 5 oxit đã cho có thể điều chế bằng phản ứng hóa hợp. Viết các phương trình hóa học
2H2 + O2
2Cu + O2
4Na + O2
4P + 5O2
C + O2
b) Các oxit có thể điều chế bằng phản ứng hóa hợp và phản ứng phân hủy: CuO, CO2.
Cu(OH)2
2Cu + O2
CaCO3
2Ca + O2
c) Các oxit có thể điều chế bằng phản ứng hóa hợp và phản ứng phân hủy: CuO, CO2, Na2O, H2O
2NaNO2
4Na + O2
Ca(HCO3)2
2H2 + O2
Câu 3
Khí CO được dùng làm chất đốt trong công nghiệp, có lẫn tạp chất là các khí CO2 và SO2. Làm thế nào có thể loại bỏ những tạp chất ra khỏi CO bằng hóa chất rẻ tiền nhất? Viết các phương trình hóa học xảy ra.
Gợi ý đáp án:
Cho hỗn hợp khí CO, CO2, SO2 lội từ từ qua dung dịch Ca(OH)2. CO2 và SO2 tác dụng với dung dịch Ca(OH)2 (dư) tạo chất không tan CaCO3 và CaSO3 còn lại khí CO không tác dụng thoát ra.
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O.
Câu 4
Cần phải điều chế một lượng muối đồng sunfat. Phương pháp nào sau đây tiết kiệm được axit sunfuric:
a) Axit sunfuric tác dựng với đồng (II) oxit.
b) Axit sunfuric đặc tác dụng với kim loại đồng.
Giải thích cho câu trả lời.
Gợi ý đáp án:
a) H2SO4 + CuO → CuSO4 + H2O (1)
b) Cu + 2H2SO4(đặc) → CuSO4 + SO2 ↑ + 2H2O (2)
Giả sử cần điều chế a mol CuSO4
Theo pt(1) nH2SO4 = nCuSO4 = a mol
Theo pt (2) nH2SO4 = 2.nCuSO4 = 2a mol
Do đó để tiết kiệm ta nên theo phản ứng (1) (phương pháp a) thì lượng axit H2SO4 sử dụng ít hơn ở phản ứng (2).
Câu 5
Hãy thực hiện những chuyển đổi hóa học sau bằng cách viết những phương trình phản ứng hóa học (ghi điều kiện của phản ứng, nếu có).
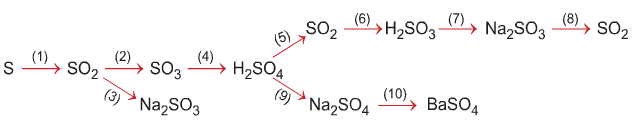
Gợi ý đáp án
Những chuyển đổi hóa học sau bằng cách viết những phương trình phản ứng hóa học (ghi điều kiện của phản ứng, nếu có).
1) S + O2
2) 2 SO2 + O2
3) SO2 + Na2 O → Na2SO3
4) SO3 + H2O → H2SO4
5) 2H2SO4 (đ) + Cu
6) SO2 + H2O → H2SO3
7) H2SO3 + 2 NaOH → Na2SO3 + 2H2O
8) Na2SO3 + 2HCl → 2 NaCl + SO2 ↑ + H2O
9) H2SO4 + 2 NaOH → Na2SO4 + 2H2O
10) Na2SO4 + BaCl2 → BaSO4 ↓ + 2 NaCl
Hoá học 9 Bài 5: Luyện tập Tính chất hóa học của oxit và axit giúp các em học sinh lớp 9 giải nhanh được các bài tập Hóa học 9 chương 1 trang 21.
Việc giải Hóa 9 bài 5 trước khi đến lớp các em nhanh chóng nắm vững kiến thức hôm sau ở trên lớp sẽ học gì, hiểu sơ qua về nội dung học. Đồng thời giúp thầy cô tham khảo, nhanh chóng soạn giáo án cho học sinh của mình. Vậy sau đây là nội dung chi tiết tài liệu, mời các bạn cùng tham khảo tại đây.
Giải bài tập Hóa 9 Bài 5 trang 21
Câu 1
Có những oxit sau: SO2, CuO, CaO, Na2O, CO2. Hãy cho biết những oxit nào tác dụng được với.
a) Nước
b) Axit clohiđric
c) Natri hiđroxit
Viết các phương trình hóa học.
Gợi ý đáp án:
a) Oxit tác dụng với nước là:
SO2 + H2O → H2SO3
Na2O + H2O → 2NaOH
CO2 + H2O → H2CO3
b) Oxit tác dụng với HCl là:
CuO + 2HCl → CuCl2 + H2O
Na2O + 2HCl → 2NaCl + H2O
CaO + 2HCl → CaCl2 + H2O
c) Những oxit tác dụng với natri hiđroxit là:
SO2 + 2NaOH → Na2SO3 + H2O
CO2 + 2NaOH → Na2CO3 + H2O
Câu 2
Những oxit nào dưới đây có thể điều chế bằng:
a) Phản ứng hóa hợp? Viết phương trình hóa học.
b) Phản ứng hóa hợp và phản ứng phân hủy? Viết phương trình hóa học.
1) H2O.
2) CuO.
3) Na2O.
4) CO2.
5) P2O5.
c) Các oxit có thể điều chế bằng phản ứng hóa hợp và phản ứng phân hủy: CuO, CO2, Na2O, H2O
Gợi ý đáp án:
a) Cả 5 oxit đã cho có thể điều chế bằng phản ứng hóa hợp. Viết các phương trình hóa học
2H2 + O2
2Cu + O2
4Na + O2
4P + 5O2
C + O2
b) Các oxit có thể điều chế bằng phản ứng hóa hợp và phản ứng phân hủy: CuO, CO2.
Cu(OH)2
2Cu + O2
CaCO3
2Ca + O2
c) Các oxit có thể điều chế bằng phản ứng hóa hợp và phản ứng phân hủy: CuO, CO2, Na2O, H2O
2NaNO2
4Na + O2
Ca(HCO3)2
2H2 + O2
Câu 3
Khí CO được dùng làm chất đốt trong công nghiệp, có lẫn tạp chất là các khí CO2 và SO2. Làm thế nào có thể loại bỏ những tạp chất ra khỏi CO bằng hóa chất rẻ tiền nhất? Viết các phương trình hóa học xảy ra.
Gợi ý đáp án:
Cho hỗn hợp khí CO, CO2, SO2 lội từ từ qua dung dịch Ca(OH)2. CO2 và SO2 tác dụng với dung dịch Ca(OH)2 (dư) tạo chất không tan CaCO3 và CaSO3 còn lại khí CO không tác dụng thoát ra.
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O.
Câu 4
Cần phải điều chế một lượng muối đồng sunfat. Phương pháp nào sau đây tiết kiệm được axit sunfuric:
a) Axit sunfuric tác dựng với đồng (II) oxit.
b) Axit sunfuric đặc tác dụng với kim loại đồng.
Giải thích cho câu trả lời.
Gợi ý đáp án:
a) H2SO4 + CuO → CuSO4 + H2O (1)
b) Cu + 2H2SO4(đặc) → CuSO4 + SO2 ↑ + 2H2O (2)
Giả sử cần điều chế a mol CuSO4
Theo pt(1) nH2SO4 = nCuSO4 = a mol
Theo pt (2) nH2SO4 = 2.nCuSO4 = 2a mol
Do đó để tiết kiệm ta nên theo phản ứng (1) (phương pháp a) thì lượng axit H2SO4 sử dụng ít hơn ở phản ứng (2).
Câu 5
Hãy thực hiện những chuyển đổi hóa học sau bằng cách viết những phương trình phản ứng hóa học (ghi điều kiện của phản ứng, nếu có).

Gợi ý đáp án
Những chuyển đổi hóa học sau bằng cách viết những phương trình phản ứng hóa học (ghi điều kiện của phản ứng, nếu có).
1) S + O2
2) 2 SO2 + O2
3) SO2 + Na2 O → Na2SO3
4) SO3 + H2O → H2SO4
5) 2H2SO4 (đ) + Cu
6) SO2 + H2O → H2SO3
7) H2SO3 + 2 NaOH → Na2SO3 + 2H2O
8) Na2SO3 + 2HCl → 2 NaCl + SO2 ↑ + H2O
9) H2SO4 + 2 NaOH → Na2SO4 + 2H2O
10) Na2SO4 + BaCl2 → BaSO4 ↓ + 2 NaCl