Or you want a quick look: Nhôm là gì?
Như các bạn cũng đã thấy, trong cuộc sống của chúng ta hiện nay. Cho dù bạn đang ở bất cứ đâu hay đi đâu thì bạn cũng đều thấy sự tồn tại của nhôm. Nhôm dường như đã bước vào từng ngõ ngách trong cuộc sống thường ngày của chúng ta.
Ngoài ra, những kiến thức liên quan đến nhôm cũng rất quan trọng. Bạn cần phải tìm hiểu thật kĩ về nhôm thì bạn mới có thể sử dụng nhôm một cách lâu dài được. Vậy tính chất hóa học của nhôm là gì? Nhôm được ứng dụng vào đời sống như thế nào? Cùng GiaiNgo theo dõi ngay sau đây bạn nhé!
Nhôm là gì?
Nhôm là gì?
Nhôm là một kim loại nhẹ và cứng. Trong ngành hóa học thế giới, nhôm còn được gọi với cái tên là kim loại trẻ. Nhôm được nhà hóa học người Anh tên là David phát hiện vào năm 1825.
Tên của nhôm có nguồn gốc từ tiếng Pháp. Trong tiếng Pháp nhôm có tên là aluminium. Trong bảng tuần hoàn hóa học, nhôm được kí hiệu là Al. Nhôm có màu sắc trắng ánh bạc, mềm và nhẹ.

Được biết rằng chúng ta rất khó để có thể tìm được nhôm nguyên chất trong tự nhiên. Thông thường, nhôm sẽ được tìm thấy khi kết hợp cùng với oxygen và những nguyên tố khác. Vì vậy, chúng ta vẫn hay gọi nhôm là hợp chất nhôm.
Đặc điểm của nhôm
Nhôm là nguyên tố phổ biến thứ 3 chỉ sau oxi và silic. Ngoài ra nhôm còn là kim loại phổ biến nhất trong vỏ trái đất. Khối lượng riêng của nhôm là 2,7g/m3.
Khối lượng riêng của nhôm khá nhỏ và chỉ bằng 1/3 thép. Lợi dụng đặc điểm này của nhôm mà người ta thường sử dụng nhôm để giảm nhẹ tối đa trọng lượng của các hệ thống hay kết cấu. Nhôm thường được sử dụng trong giao thông vận tải và công nghiệp hàng không vũ trụ.
Nhôm rất dễ dát mỏng, nhẹ và dẫn điện tốt. Mặc dù nhôm dẫn điện tốt sau đồng, nhưng nhôm vẫn được sử dụng để truyền điện. Vì nhôm nhẹ hơn đồng có thể dễ dàng vận chuyển và bị nung nóng ít hơn đồng.
Nhôm còn có một lớp màng bọc oxy hóa nên nhôm có độ bền với thời tiết khá cao. Chính vì đặc điểm này mà nhôm thường được dùng làm cửa và những vật dụng có thể để được ngoài trời.

Một đặc điểm khác nữa là nhôm có tính dẻo khá cao. Nhôm rất dễ biến dạng trong môi trường lạnh hoặc nóng. Vì vậy, nhôm được sử dụng một cách linh hoạt trong các ngành sản xuất.
Vị trí của nhôm trong bảng tuần hoàn hoá học
Nhôm trong bảng tuần hoàn hóa học được kí hiệu là Al. Nhôm ở vị trí số 13 trong chu kì 3. Nhôm thuộc nhóm IIIA.
Trạng thái tự nhiên của nhôm
Nhôm là một kim loại thường thấy ở bên trong vỏ trái đất. Trong tự nhiên, nhôm rất hiếm khi được tìm thấy ở dạng nguyên chất. Nhôm thường có trong các hợp chất ở đất sét, boxit hay criolit.
Cụ thể, trong tự nhiên nhôm có:
- Trong đất sét, nhôm thuộc hợp chất: Al2O3.2Sio2.2H2O.
- Trong mica: K2O.Al2O3.6Sio2.2H2O.
- Trong boxit: Al2O3.nH2O.
- Trong criolit: 3NaF.AlF3 hoặc (Na3AlF6).

Sau khi đã hiểu hơn về nhôm là gì. Nhôm có những đặc điểm nổi bật như thế nào. Thì tiếp theo đây hãy cùng GiaiNgo tìm hiểu sâu hơn về tính chất hóa học của nhôm là gì nhé!
Tính chất hóa học của nhôm
Có bao nhiêu tính chất hóa học của nhôm? GiaiNgo sẽ cùng bạn tìm hiểu ngay sau đây nhé!
Tác dụng với phi kim
Như bạn đã biết, nhôm có một lớp oxit bảo vệ trên bề mặt. Vì vậy, nhôm sẽ phản ứng được với oxi trên bề mặt. Vì khi phản ứng giữa nhôm và oxi xảy ra thì sẽ tạo ra một lớp màng oxit trên bề mặt. Từ đó, nó có thể bảo vệ và ngăn chặn nhôm tham gia phản ứng tiếp theo
2Al + 3O2 → Al2O3
Ngoài tác dụng với oxi. Nhôm còn có thể tác dụng với một số phi kim khác để tạo ra muối:
2Al + 3Cl2 → 2AlCl3
2Al + 3S → (đun nóng) Al2S3
Tác dụng với nước
Trên thực tế, do có lớp màng oxit mỏng, bền bảo vệ và bao phủ lên nhôm nên nhôm sẽ không phản ứng được với nước. Nhưng khi phá bỏ lớp oxit (hoặc tạo hỗn hợp Al-Hg, vì nó sẽ ngăn không cho nhôm tác dụng với oxi tạo oxit) thì nhôm phản ứng ngay với nước giải phóng hydro và năng lượng:
2Al + 6H2O → 2Al(OH)3 + 3H2
Tuy nhiên, tính chất hóa học của nhôm khi tác dụng với nước chỉ có ý nghĩa về mặt lý thuyết. Bởi vì khi sản sinh ra Al(OH)3 là một chất kết tủa dạng keo màu trắng. Nó sẽ bao kín bề mặt của nhôm và ngăn không cho nhôm tiếp xúc với nước để xảy ra phản ứng tiếp theo nữa.
Tác dụng với dung dịch axit
Một tính chất hóa học của nhôm tiếp theo nữa đó là nhôm có thể tác dụng với những dung dịch axit khác nhau. Từ đó tạo ra các phản ứng khác nhau.
Nhôm có thể dễ dàng tác dụng với dung dịch axit HCl và H2SO4 loãng. Phản ứng này sẽ tạo ra muối và giải phóng khí Hidro:
2Al + 6HCl → 2AlCl3 + 3H2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Ngoài ra, nhôm còn có thể tác dụng với các dung dịch axit có tính oxi hóa mạnh như HNO3 hoặc H2SO4 đặc, nóng.
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
Một lưu ý khi nhôm tác dụng với dung dịch axit đó là do bị thụ động hóa bới lớp oxit bao bọc bên ngoài nên nhôm không thể tác dụng với HNO3 và H2SO4 đặc, nguội.
Tác dụng với dung dịch bazơ
Nhôm có thể tham gia phản ứng dễ dàng với các dung dịch kiềm:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Cơ chế phản ứng của nhôm và dung dịch bazơ như sau. Đầu tiên nhôm sẽ phản ứng với nước và sẽ sinh ra Al(OH)3. Tuy nhiên phản ứng này mau chóng dừng lại vì tạo lớp kết tủa keo lắng xuống, ngăn cản phản ứng xảy ra.
Al(OH)3 là một hidroxit lưỡng tính và có thể tan được trong dung dịch kiềm. Nếu muốn phản ứng tiếp tục xảy ra thì chúng ta sẽ ngâm Al(OH)3 vào một dung dịch kiềm. Lúc này phản ứng sẽ tiếp tục xảy ra và lặp đi lặp lại cho đến khi Al bị hòa tan hết.
Tác dụng với dung dịch muối
Đối với tính chất hóa học của nhôm tác dụng với muối thì nhôm có thể dễ dàng đẩy các kim loại đứng sau nhôm ra khỏi dung dịch muối của chúng. Những kim loại đứng sau nhôm là Zn, Fe, Ni, Sn, Pb, Cu, Ag, Hg, Pt.
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Ngoài ra, nhôm còn có thể phản ứng với muối nitrat trong môi trường kiềm và cả môi trường axit:
8Al + 3NaNO3 + 5NaOH + 2H2O → NaAlO2 + 3NH3
Tác dụng với oxit kim loại (Phản ứng nhiệt nhôm)
Tính chất hóa học của nhôm cuối cùng là tác dụng với oxit kim loại kém hoạt động hơn. Hay còn gọi là phản ứng nhiệt nhôm.
Phản ứng nhiệt nhôm là phản ứng hóa học toả nhiệt trong đó nhôm là chất khử ở nhiệt độ cao. Nổi bật nhất là phản ứng nhiệt nhôm giữa oxit sắt III và nhôm:
Fe2O3 + 2 Al → 2 Fe + Al2O3
Một số phản ứng nhiệt nhôm có thể kể đến như:
3CuO+ 2Al → Al2O3 + 3Cu
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
3Mn3O4 + 8Al → 4Al2O3 + 9Mn
Cr2O3 + 2Al→ Al2O3 + 2Cr
Phản ứng nhiệt nhôm là phản ứng dùng để khử oxit kim loại mà không cần dùng cacbon. Phản ứng nhiệt nhôm còn được sử dụng để điều chế các kim loại có nhiệt độ nóng chảy cao (như crôm hay Von farm). Do tính chất thụ động với H2SO4 đặc nguội và HNO3 đặc nguội, người ta sẽ sử dụng thùng nhôm để chuyên chở hai loại axit này.

Bài viết liên quan:
Tính chất vật lý của nhôm
Nhôm có đặc điểm là có cấu trúc mạng lập phương tâm diện. Ngoài ra nhôm dẫn điện rất tốt. Nhôm còn dẫn nhiệt tốt gấp 3 lần so với sắt. Nhôm được nóng chảy ở nhiệt độ 660 độ C.
Nếu quan sát bằng mắt thường, nhôm có màu trắng bạc, bền và dai. Chúng ta có thể dễ dàng kéo sợi hay dát mỏng nhôm.
Tỷ trọng của nhôm chỉ bằng 1/3 so sắt hoặc đồng. Nhôm rất mềm, chỉ sau vàng. Nhôm rất dễ bị uốn cong, vì vậy mà nhôm được dùng để gia công trên máy móc.
Ngoài ra nhôm còn có khả năng chống ăn mòn và khá là bền do có lớp oxy hóa được phủ bên ngoài. Nhôm cũng sẽ không bị nhiễm từ và không dễ cháy khi để ở ngoài không khí trong điều kiện bình thường.

Ứng dụng và điều chế nhôm
Ứng dụng nhôm trong cuộc sống hiện nay
Sau khi đã tìm hiểu kĩ về tính chất hóa học của nhôm là gì. Thì dựa vào những tính chất hóa học của nhôm mà nhôm được ứng dụng khá rộng rãi trong cuộc sống hiện nay.
Sau đây là 3 ứng dụng của nhôm trong cuộc sống mà bạn cần phải biết:
Trong ngành xây dựng
Bởi tính bền, nhẹ và không dễ bị oxi hóa của nhôm. Mà nhôm được ứng dụng khá rộng rãi trong ngành xây dựng. Những đồ dùng hay các thiết kế được làm từ các hợp chất của nhôm luôn mang lại độ hiệu quả bền bỉ cao. Một vài đồ dùng trong ngành xây dựng được làm bằng nhôm có thể kể đến như:
- Tôn
- Cửa đi chính
- Cửa sổ
- Mái hiên
- Khung sườn nhôm
- Vách ngăn
- Khung cửa,…
Trong các ngành công nghiệp
Nhôm là một kim loại nhẹ và có khối lượng riêng rất nhỏ. Ngoài ra nhôm còn có khả năng chống ăn mòn hiện tượng thụ động. Các thành phần cấu trúc mà được làm từ nhôm và hợp chất của nó rất quan trọng và mang lại lợi ích khá lớn cho các ngành công nghiệp hiện nay.
Một số chế tạo từ nhôm và hợp chất của nhôm trong ngành công nghiệp có thể kể đến như:
- Khung máy
- Vỏ máy tính được làm từ hợp kim nhôm
- Một số phần từ các loại xe máy, xe oto được làm từ nhôm
- Dây cáp điện bằng nhôm
- Thùng xe tải
- Là vật liệu để chế tạo tàu bay, tên lửa
- Bộ tản nhiệt của CPU trong máy tính
- Vỏ điện thoại, các chi tiết nhỏ bên trong,…

Trong hàng tiêu dùng
Nhờ độ bền cao của nhôm và không dễ bị oxy hóa. Ứng dụng của nhôm và hợp chất của nhôm trong đồ tiêu dùng là rõ ràng nhất và nhiều nhất. Một vài đồ tiêu dùng được làm từ nhôm như:
- Bàn, ghế
- Tủ quần áo
- Khung tủ đựng chén
- Kệ chén
- Giường
- Thanh treo màn
- Dụng cụ nấu ăn,…

Điều chế nhôm như thế nào?
Dựa vào các tính chất hóa học của nhôm. Người ta có thể điều chế nhôm bằng phương pháp điện phân nóng chảy. Đây là cách điều chế nhôm hiệu quả nhất hiện nay vì nhôm tồn tại chủ yếu ở dạng hợp kim.
Mục đích của quá trình điều chế này là chúng ta phải tách nhôm ra khỏi quặng boxit Al2O3 (thường bị lẫn SiO2 và Fe2O3). Các giai đoạn điều chế nhôm như sau:
Tinh chế quặng boxit Al2O3
Đây là giai đoạn đầu tiên và khá quan trọng. Giai đoạn này sẽ làm sạch nguyên liệu để nhôm được điều chế ra không có lẫn tạp chất. Chúng ta làm sạch nguyên liệu bằng cách cho phản ứng với dung dịch kiềm để tách riêng Al2O3:
2NaOH + Al2O3 → 2NaAlO2 + H2O
2NaOH + SiO2 → Na2SiO3 + H2O
Sau đó chúng ta sẽ sục khí CO2 dư vào dung dịch:
NaAlO2 + CO2 + 2H2O → NaHCO3 + Al(OH)3
NaOH + CO2 → NaHCO3
Cuối cùng của giai đoạn này. Chúng ta lấy kết tủa nung ở 900 độ C sẽ thu được oxit nhôm tinh khiết:
2Al(OH)3 → Al2O3 + 3H2O
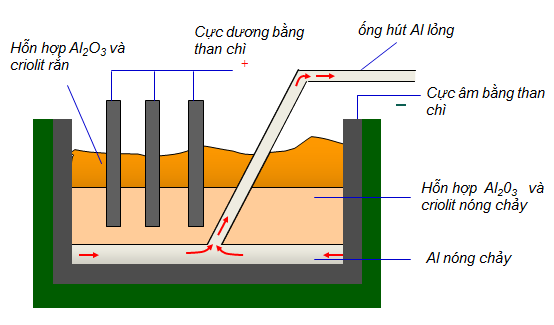
Điện phân Al2O3 nóng chảy
Chúng ta điện phân nóng chảy Al2O3 có mặt của criolit Na3AlF6 (giúp hạ nhiệt độ nóng chảy của Al2O3 từ 2050 độ C xuống 900 độ C. Sau đó thì tăng độ dẫn điện để tạo thành nhiều ion hơn; tạo lớp bảo vệ không cho O2 phản ứng với Al nóng chảy):
2Al2O3 → (nhiệt độ) 4Al + 3O2
Một lưu ý rằng trong quá trình điện phân chúng ta phải thường xuyên hạ thấp điện cực. Vì quá trình điện phân thường dùng điện cực bằng than chì nên có phản ứng phụ giữa điện cực và oxi ở cực dương (tạo khí CO và CO2).
 Trên đây là toàn bộ kiến thức hóa học liên quan đến tính chất hóa học của nhôm. Hy vọng qua bài viết này của GiaiNgo bạn đã nắm rõ hơn về tính chất hóa học của nhôm và các ứng dụng của nhôm. Hãy theo dõi GiaiNgo mỗi ngày để cập nhật thêm nhiều thông tin hay nhé!
Trên đây là toàn bộ kiến thức hóa học liên quan đến tính chất hóa học của nhôm. Hy vọng qua bài viết này của GiaiNgo bạn đã nắm rõ hơn về tính chất hóa học của nhôm và các ứng dụng của nhôm. Hãy theo dõi GiaiNgo mỗi ngày để cập nhật thêm nhiều thông tin hay nhé!