Or you want a quick look: Lý thuyết liên kết hóa học lớp 10
Liên kết hóa học là nội dung quan trọng trong chương trình hóa học Trung học phổ thông. Vậy liên kết hóa học là gì? Kiến thức về chuyên đề liên kết hóa học lớp 10? Các dạng bài tập liên kết hóa học? Công thức tính độ dài liên kết hóa học?… Trong nội dung bài viết sau đây, DINHNGHIA.COM.VN sẽ giúp bạn tổng kết các thông tin hữu ích về chủ đề liên kết hóa học là gì, cùng tìm hiểu nhé!.
Vuidulich.vn cũng giúp giải đáp những vấn đề sau đây:- Liên kết cộng hóa trị là gì
- Liên kết hóa học là gì
- Liên kết hóa học là sự kết hợp
- Ch4 là liên kết cộng hóa trị gì
- Các loại liên kết hóa học lớp 10
- Liên kết hóa học nào bền nhất
- Liên kết hóa học giữa các ion được gọi là
- Liên kết ion là gì
liên kết hóa học
Nội dung chính bài viết
Lý thuyết liên kết hóa học lớp 10
Liên kết hóa học là gì?
Liên kết hóa học được định nghĩa là lực giúp giữ cho các nguyên tử cùng nhau trong phân tử hay tinh thể. Sự hình thành của các liên kết hóa học giữa những nguyên tố để tạo nên phân tử được hệ thống hóa thành các lý thuyết liên kết hóa học.
Phân loại liên kết hóa học
Các đặc trưng của không gian và khoảng năng lượng tương tác bởi các lực hóa học nối với nhau thành một sự liên tục, do đó các thuật ngữ cho các dạng liên kết hóa học khác nhau là rất tương đối cũng như ranh giới giữa chúng là không rõ ràng. Nhìn chung mọi liên kết hóa học đều nằm trong những dạng liên kết hóa học sau như sau:
Sự tạo thành liên kết ion, anion, cation
Sự tạo thành ion
- Trong phản ứng hóa học thì khi nguyên tử hay phân tử thêm hoặc mất bớt electron nó sẽ tạo thành các phần tử mang điện được gọi là ion. Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo thành hợp chất chứa liên kết ion.
- Điều kiện hình thành liên kết ion như sau:
- Liên kết được hình thành giữa các nguyên tố có tính chất khác hẳn nhau (kim loại điển hình và phi kim điển hình).
- Quy ước hiệu độ âm điện giữa hai nguyên tử liên kết (geq 1,7) là liên kết ion (trừ một số trường hợp).
- Dấu hiệu cho thấy phân tử có liên kết ion:
- Phân tử hợp chất được hình thành từ kim loại điển hình (kim loại nhóm IA, IIA) và phi kim điển hình (phi kim nhóm VIIA và Oxi).
- Ví dụ: Các phân tử (NaCl, MgCl_{2},BaF_{2}),…đều chứa liên kết ion, là liên kết được hình thành giữa các cation kim loại và anion phi kim.
-
- Phân tử hợp chất muối chứa cation hoặc anion đa nguyên tử.
- Ví dụ: Các phân tử (NH_{4}Cl, MgSO_{4}, AgNO_{3}),… đều chứa liên kết ion, là liên kết được hình thành giữa cation kim loại hoặc amoni và anion gốc axit.
Đặc điểm của hợp chất ion
- Các hợp chất ion đều có nhiệt độ nóng chảy và nhiệt độ sôi cao, do đó dẫn điện khi tan trong nước hoặc nóng chảy.
- Ion được chia thành cation và anion:
- Cation: Ion dương.
- Anion: Ion âm.
Sự tạo thành cation
- Ion mang điện tích dương được gọi là ion dương hay cation.
- Nếu như các nguyên tử nhường bớt electron khi tham gia phản ứng hóa học thì nó sẽ trở thành các phần tử mang điện tích dương hay còn gọi là cation.
Ví dụ : Sự hình thành Cation của nguyên tử Li (Z=3)
- Cấu hình e: (1s^{2}2s^{1})
(begin{matrix} 1s^2s^{1} rightarrow 1s^{2} + 1e (Li),, , , , , , , , , , , , (Li^{+}) end{matrix})
- Hay: (Li rightarrow Li^{+} + 1e)
(Li^{+}) được gọi là cation liti
Sự tạo thành anion
- Ion mang điện tích âm được gọi là ion âm hay anion.
- Nếu các nguyên tử nhận thêm electron trong khi tham gia phản ứng hóa học thì nó sẽ trở thành các phần tử mang điện tích âm (anion).
Ví dụ : Sự hình thành anion của nguyên tử F (Z=9)
- Cấu hình e: (1s^{2}2s^{2}2p^{5})
(begin{matrix} 1s^{2}2s^{2}2p^{5} + 1e rightarrow 1s^{2}2s^{2}2p^{6} (F), , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , (F^{-}) end{matrix})
Hay: (F + 1e rightarrow F^{-})
(F^{-}) được gọi là anion florua
Ion đơn nguyên tử và ion âm đa nguyên tử
- Ion đơn nguyên tử là ion tạo nên từ 1 nguyên tử .
Ví dụ cation (Li^{+} , Na^{+}, Mg^{2+}, Al^{3+}) và anion (F^{-}, Cl^{-}, S^{2-}),…
- Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hay âm.
Ví dụ: cation amoni (NH_{4}^{+}), anion hidroxit (OH^{-}), anion sunfat (SO_{4}^{2-}),…
Kiến thức về liên kết cộng hóa trị
Định nghĩa liên kết cộng hóa trị
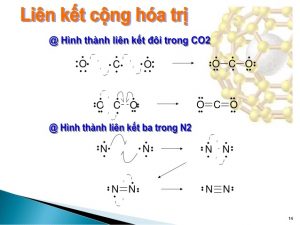
Liên kết cộng hóa trị được biết đến là liên kết được hình thành giữa 2 nguyên tử bằng một hay nhiều cặp electron dùng chung.
Điều kiện hình thành liên kết cộng hóa trị
Các nguyên tử giống nhau hoặc gần giống nhau, liên kết với nhau bằng cách góp chung các electron hóa trị.
Ví dụ: (Cl_{2}, H_{2}, N_{2}, HCl, H_{2}O),…
Dấu hiệu phân tử có liên kết cộng hóa trị
- Phân tử đơn chất được hình thành từ phi kim.
Ví dụ: Các phân tử (O_{2},F_{2},H_{2},N_{2}),… đều chứa liên kết cộng hóa trị, là liên kết được hình thành giữa hai nguyên tử phi kim giống nhau.
- Phân tử hợp chất được hình thành từ các phi kim.
Ví dụ: Các phân tử (F_{2}O,HF,H_{2}O,NH_{3},CO_{2}),… đều chứa liên kết hóa trị, là liên kết được hình thành giữa hai nguyên tử phi kim khác nhau.
Cách phân loại liên kết cộng hóa trị
- Liên kết cộng hóa trị có cực: Khi cặp liên electron dùng chung phân bố đối xứng giữa hai hạt nhân nguyên tử than gia liên kết thì đó là liên kết hóa trị không phân cực.
- Liên kết cộng hóa trị không cực: Khi cặp electron dùng chung bị hút lệch về nguyên tử có độ âm điện lớn hơn thì đó là liên kết cộng hóa trị có cực.
Chú ý
- Liên kết cộng hóa trị không phân cực (0,0 leq Delta lambda < 0,4)
- Liên kết cộng hóa trị phân cực: (0,4 leq Delta lambda < 1,7)
- Liên kết ion: (Delta lambda geq 1,7)
- Liên kết cho – nhận: là trường hợp đặc biệt của liên kết cộng hóa trị khi cặp electron dùng chung chỉ do một nguyên tử đóng góp. Nguyên tử đóng góp cặp electron là nguyên tử cho, nguyên tử nhận cặp electron gọi là nguyên tử nhân. Liên kết cho – nhận biểu diễn bằng mũi tên “ (rightarrow) ”, gốc mũi tên là nguyên tử cho, đầu mũi tên là nguyên tử nhận.
- Điều kiện hình thành liên kết cho – nhận: Nguyên tử cho phải có cặp electron chưa tham gia liên kết, nguyên tử nhận phải có obitan trống (hoặc dồn hai electron độc thân lại để tạo ra obitan trống).
Kiến thức về liên kết kim loại
- Liên kết kim loại theo định nghĩa chính là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể bởi sự tham gia của các electron tự do.
- Mạng tinh thể kim loại: tồn tại 3 dạng phổ biến
- Lập phương tâm khối: các nguyên tử, ion kim loại nằm trên các đỉnh và tâm của hình lập phương.
- Lập phương tâm diện: các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các mặt của hình lập phương.
- Lục phương: các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các mặt của hình lục giác đứng và 3 nguyên tử, ion nằm phía trong của hình lục giác.
So sánh các loại liên kết hóa học
Dưới đây là bảng so sánh một số tính chất giống và khác nhau của 3 loại liên kết: Liên kết ion, liên kết cộng hóa trị không cực và liên kết cộng hóa trị có cực.

Các dạng bài tập về liên kết hóa học
Dạng 1: Sự hình thành liên kết ion
Ví dụ 1: Viết cấu hình electron của Cl (Z = 17) và Ca (Z=20). Cho biết vị trí của chúng (chu kì, nhóm) trong bảng tuần hoàn. Liên kết giữa canxi và clo trong hợp chất (CaCl_{2}) thuộc loại liên kết gì? Vì sao? Viết sơ đồ hình thành liên kết đó.
Cách giải:
Cl (Z = 17) : (1s^{2}2s^{2}2p^{6}3s^{2}3p^{5})
Ca (Z = 20) : (1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{2})
Clo nằm ở ô số 17, chu kỳ 3, nhóm VIIA.
Canxi nằm ở ô số 20, chu kỳ 4, nhóm IIA.
Liên kết trong hợp chất (CaCl_{2}) là liên kết ion vì Ca là kim loại điển hình, Cl là phi kim điển hình.
Sơ đồ hình thành liên kết:
(2Cl + 2.1e rightarrow 2Cl^{-})
(Ca rightarrow Ca^{2+} + 2e)
Các ion (Ca^{2+}) và (Cl^{-}) tạo thành mang điện tích trái dấu, chúng hút nhau bằng lực hút tĩnh điện, tạo thành hợp chất (CaCl_{2}):
(Ca^{2+} + 2Cl^{-} rightarrow CaCl_{2})
Dạng 2: Sự hình thành liên kết cộng hóa trị
Ví dụ 2: X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
- Viết cấu hình electron nguyên tử của các nguyên tố đó.
- Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và Z, Z và X.
Cách giải:
- 9X : (1s^{2}2s^{2}2p^{5}) Đây là F có độ âm điện là 3,98.
19A : (1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{1}) Đây là K có độ âm điện là 0,82.
8Z: (1s^{2}2s^{2}2p^{4}) Đây là O có độ âm điện là 3,44.
2. Cặp X và A, hiệu số độ âm điện là: 3,98 – 0,82 = 3,16, có liên kết ion.Cặp A và Z, hiệu số độ âm điện là: 3,44 – 0,82 = 2,62, có liên kết ion.
Dạng 3: Cách viết công thức cấu tạo của các phân tử
Ví dụ 3: Viết công thức electron và công thức cấu tạo các ion đa nguyên tử sau: (CO_{3}^{2-}, HCO_{3}^{-})
Cách giải:

Như vậy, bài viết trên đây của DINHNGHIA.COM.VN đã giúp bạn có được những kiến thức bổ ích về chủ đề liên kết hóa học là gì. Mong rằng qua những thông tin trên đây bạn đã tìm thấy kiến thức cần thiết cho quá trình tìm tòi và học tập của mình. Nếu có bất cứ thắc mắc gì về chủ đề bài viết liên kết hóa học là gì, đừng quên để lại ở phần nhận xét bên dưới. Chúc bạn luôn học tập tốt!.
Xem thêm: Xem chi tiết qua bài giảng dưới đây của thầy Đặng Xuân Chất Vuidulich.vn cũng giúp giải đáp những vấn đề sau đây:- Liên kết cộng hóa trị là gì
- Liên kết hóa học là gì
- Liên kết hóa học là sự kết hợp
- Ch4 là liên kết cộng hóa trị gì
- Các loại liên kết hóa học lớp 10
- Liên kết hóa học nào bền nhất
- Liên kết hóa học giữa các ion được gọi là
- Liên kết ion là gì
(Nguồn: www.youtube.com)