Or you want a quick look: Lý thuyết Tính chất hóa học của kim loại
Hoá học 9 Bài 16 giúp các em học sinh lớp 9 nắm vững kiến thức về các tính chất hóa học của kim loại. Đồng thời giải nhanh được các bài tập Hóa học 9 chương 2 trang 51.
Việc giải Hóa 9 bài 16 trước khi đến lớp các em nhanh chóng nắm vững kiến thức hôm sau ở trên lớp sẽ học gì, hiểu sơ qua về nội dung học. Đồng thời giúp thầy cô tham khảo, nhanh chóng soạn giáo án cho học sinh của mình. Vậy sau đây là nội dung chi tiết tài liệu, mời các bạn cùng tham khảo tại đây.
Lý thuyết Tính chất hóa học của kim loại
I. Tác dụng với phi kim
1. Với oxi
Nhiều kim loại phản ứng được với oxi tạo thành oxit.
3Fe + 2O2
Trừ Ag, Au, Pt không phản ứng được với oxi
2. Với lưu huỳnh
– Nhiều kim loại phản ứng được với lưu huỳnh tạo thành muối sunfua (=S)
2Al + 2S
3. Phản ứng với clo
Nhiều kim loại phản ứng được với clo tạo thành muối clorua (-Cl)
2Fe + 3Cl2
II. Tác dụng với axit
Dung dịch axit HCl, H2SO4 loãng (chỉ có kim loại đứng trước H mới phản ứng)
2Al + 6HCl → 2AlCl3 + 3H2
III. Tác dụng với dung dịch muối
Trừ K, Na, Ca, Ba không đẩy được kim loại vì tác dụng ngay với nước
Kim loại đứng trước đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng.
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
Giải bài tập Hóa 9 Bài 16 trang 51
Câu 1
Kim loại có những tính chất hóa học nào? Lấy ví dụ và viết các phuwong trình hóa học minh họa với kim loại magie.
Gợi ý đáp án
Kim loại có những tính chất hóa học chung:
1. Phản ứng của kim loại với phi kim:
2Mg + O2 → 2MgO
Mg + Cl2 → MgCl2
2. Phản ứng của kim loại với dung dịch axit:
Mg + 2HCl → MgCl2 + H2 ↑
Mg + H2SO4loãng → MgSO4 + H2 ↑
3. Phản ứng của kim loại với dung dịch muối:
Mg + CuSO4 → MgSO4 + Cu.
Câu 2
Hãy hoàn thành các phương trình hóa học sau đây:
a) … + HCl -⇒ MgCl2 + H2
b) … + AgNO3 ⇒ Cu(NO3)2 + Ag
c) … + … ⇒ ZnO
d) … + Cl2 ⇒ HgCl2
e) … + S ⇒ K2S.
Gợi ý đáp án
Phương trình hóa học:
a) Mg + 2HCl → MgCl2 + H2 ↑
b) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
c) 2Zn + O2 → 2ZnO
d) Hg + Cl2 → HgCl2
e) 2K + S → K2S.
Câu 3
Viết các phương trình hóa học xảy ra giữa các cặp chất sau đây:
a) Kẽm + axit sunfuric loãng.
b) Kẽm + dung dịch bạc nitrat.
c) Natri + lưu huỳnh.
d) Canxi + clo.
Gợi ý đáp án
Các phương trình phản ứng hóa học:
a) Zn + H2SO4loãng → ZnSO4 + H2 ↑
b) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
c) 2Na + S → Na2S
d) Ca + Cl2 → CaCl2.
Câu 4
Dựa vào tính chất hóa học của kim loại, hãy viết các phương trình hóa học biểu diễn các chuyển hóa sau đây:
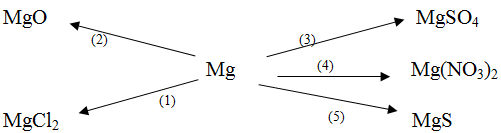
Gợi ý đáp án
(1) Mg + Cl2 → MgCl2
(2) 2Mg + O2 → 2MgO
(3) Mg + H2SO4loãng → MgSO4 + H2 ↑
(4) Mg + 2AgNO3 → Mg(NO3)2 + 2Ag ↓
(5) Mg + S → MgS
Câu 5
Dự đoán hiện tượng và viết phương trình hóa học xảy ra, khi:
a) Đốt dây sắt trong khí clo.
b) Cho một đinh sắt vào trong ống nghiệm đựng dung dịch CuCl2.
c) Cho một viên kẽm vào dung dịch CuSO4.
Gợi ý đáp án
a) Khối màu nâu tạo thành:
2Fe + 3Cl2 → 2FeCl3
b) Dung dịch CuCl2 nhạt màu xanh, kim loại màu đỏ bám vào đinh sắt.
Fe + CuCl2 → FeCl2 + Cu ↓
c) Zn tan dần, dung dịch CuSO4 nhạt màu xanh, kim loại màu đỏ bám vào viên kẽm.
Zn + CuSO4 → ZnSO4 + Cu ↓
Câu 6
Ngâm một lá kẽm trong 20 g dung dịch muối đồng sunfat 10% cho đến khi kẽm không tan được nữa. Tính khối lượng kẽm đã phản ứng với dung dịch trên và nồng độ phần trăm của dung dịch sau phản ứng.
Gợi ý đáp án
1 mol 1 mol 1 mol 1 mol
? 0,0125 mol ?
Theo phương trình:
Theo phương trình:
Ta có: mdd sau pứ =
Câu 7
Ngâm một lá đồng trong 20 ml dung dịch bạc nitrat cho tới khi đồng không thể tan thêm được nữa. Lấy lá đồng ra, rửa nhẹ, làm khô và cân thì thấy khối lượng lá đồng tăng thêm 1,52 g. Hãy xác định nổng độ mol của dung dịch bạc nitrat đã dùng (giả thiết toàn bộ lượng bạc giải phóng bám hết vào lá đồng).
Gợi ý đáp án
PTHH: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
Gọi x là số mol Cu phản ứng
Theo phương trình ta có: nAg sinh ra = 2nCu pư = 2x mol
Khối lượng lá đồng tăng thêm 1,52g ⇒ mAg sinh ra – mCu pư = 1,52
⇒ 108. 2x – 64x = 1,52 ⇒ x = 0,01 (mol)
Theo pt nAgNO3 = 2.nCu = 2. 0,01 = 0,02 mol
Nồng độ dung dịch AgNO3:
Hoá học 9 Bài 16 giúp các em học sinh lớp 9 nắm vững kiến thức về các tính chất hóa học của kim loại. Đồng thời giải nhanh được các bài tập Hóa học 9 chương 2 trang 51.
Việc giải Hóa 9 bài 16 trước khi đến lớp các em nhanh chóng nắm vững kiến thức hôm sau ở trên lớp sẽ học gì, hiểu sơ qua về nội dung học. Đồng thời giúp thầy cô tham khảo, nhanh chóng soạn giáo án cho học sinh của mình. Vậy sau đây là nội dung chi tiết tài liệu, mời các bạn cùng tham khảo tại đây.
Lý thuyết Tính chất hóa học của kim loại
I. Tác dụng với phi kim
1. Với oxi
Nhiều kim loại phản ứng được với oxi tạo thành oxit.
3Fe + 2O2
Trừ Ag, Au, Pt không phản ứng được với oxi
2. Với lưu huỳnh
– Nhiều kim loại phản ứng được với lưu huỳnh tạo thành muối sunfua (=S)
2Al + 2S
3. Phản ứng với clo
Nhiều kim loại phản ứng được với clo tạo thành muối clorua (-Cl)
2Fe + 3Cl2
II. Tác dụng với axit
Dung dịch axit HCl, H2SO4 loãng (chỉ có kim loại đứng trước H mới phản ứng)
2Al + 6HCl → 2AlCl3 + 3H2
III. Tác dụng với dung dịch muối
Trừ K, Na, Ca, Ba không đẩy được kim loại vì tác dụng ngay với nước
Kim loại đứng trước đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng.
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
Giải bài tập Hóa 9 Bài 16 trang 51
Câu 1
Kim loại có những tính chất hóa học nào? Lấy ví dụ và viết các phuwong trình hóa học minh họa với kim loại magie.
Gợi ý đáp án
Kim loại có những tính chất hóa học chung:
1. Phản ứng của kim loại với phi kim:
2Mg + O2 → 2MgO
Mg + Cl2 → MgCl2
2. Phản ứng của kim loại với dung dịch axit:
Mg + 2HCl → MgCl2 + H2 ↑
Mg + H2SO4loãng → MgSO4 + H2 ↑
3. Phản ứng của kim loại với dung dịch muối:
Mg + CuSO4 → MgSO4 + Cu.
Câu 2
Hãy hoàn thành các phương trình hóa học sau đây:
a) … + HCl -⇒ MgCl2 + H2
b) … + AgNO3 ⇒ Cu(NO3)2 + Ag
c) … + … ⇒ ZnO
d) … + Cl2 ⇒ HgCl2
e) … + S ⇒ K2S.
Gợi ý đáp án
Phương trình hóa học:
a) Mg + 2HCl → MgCl2 + H2 ↑
b) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
c) 2Zn + O2 → 2ZnO
d) Hg + Cl2 → HgCl2
e) 2K + S → K2S.
Câu 3
Viết các phương trình hóa học xảy ra giữa các cặp chất sau đây:
a) Kẽm + axit sunfuric loãng.
b) Kẽm + dung dịch bạc nitrat.
c) Natri + lưu huỳnh.
d) Canxi + clo.
Gợi ý đáp án
Các phương trình phản ứng hóa học:
a) Zn + H2SO4loãng → ZnSO4 + H2 ↑
b) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
c) 2Na + S → Na2S
d) Ca + Cl2 → CaCl2.
Câu 4
Dựa vào tính chất hóa học của kim loại, hãy viết các phương trình hóa học biểu diễn các chuyển hóa sau đây:
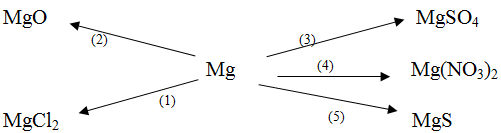
Gợi ý đáp án
(1) Mg + Cl2 → MgCl2
(2) 2Mg + O2 → 2MgO
(3) Mg + H2SO4loãng → MgSO4 + H2 ↑
(4) Mg + 2AgNO3 → Mg(NO3)2 + 2Ag ↓
(5) Mg + S → MgS
Câu 5
Dự đoán hiện tượng và viết phương trình hóa học xảy ra, khi:
a) Đốt dây sắt trong khí clo.
b) Cho một đinh sắt vào trong ống nghiệm đựng dung dịch CuCl2.
c) Cho một viên kẽm vào dung dịch CuSO4.
Gợi ý đáp án
a) Khối màu nâu tạo thành:
2Fe + 3Cl2 → 2FeCl3
b) Dung dịch CuCl2 nhạt màu xanh, kim loại màu đỏ bám vào đinh sắt.
Fe + CuCl2 → FeCl2 + Cu ↓
c) Zn tan dần, dung dịch CuSO4 nhạt màu xanh, kim loại màu đỏ bám vào viên kẽm.
Zn + CuSO4 → ZnSO4 + Cu ↓
Câu 6
Ngâm một lá kẽm trong 20 g dung dịch muối đồng sunfat 10% cho đến khi kẽm không tan được nữa. Tính khối lượng kẽm đã phản ứng với dung dịch trên và nồng độ phần trăm của dung dịch sau phản ứng.
Gợi ý đáp án
1 mol 1 mol 1 mol 1 mol
? 0,0125 mol ?
Theo phương trình:
Theo phương trình:
Ta có: mdd sau pứ =
Câu 7
Ngâm một lá đồng trong 20 ml dung dịch bạc nitrat cho tới khi đồng không thể tan thêm được nữa. Lấy lá đồng ra, rửa nhẹ, làm khô và cân thì thấy khối lượng lá đồng tăng thêm 1,52 g. Hãy xác định nổng độ mol của dung dịch bạc nitrat đã dùng (giả thiết toàn bộ lượng bạc giải phóng bám hết vào lá đồng).
Gợi ý đáp án
PTHH: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
Gọi x là số mol Cu phản ứng
Theo phương trình ta có: nAg sinh ra = 2nCu pư = 2x mol
Khối lượng lá đồng tăng thêm 1,52g ⇒ mAg sinh ra – mCu pư = 1,52
⇒ 108. 2x – 64x = 1,52 ⇒ x = 0,01 (mol)
Theo pt nAgNO3 = 2.nCu = 2. 0,01 = 0,02 mol
Nồng độ dung dịch AgNO3: